
Hasta el siglo XVIII se creyó que el agua era un elemento, fue el químico ingles Cavendish quien sintetizó agua a partir de una combustión de aire e hidrógeno. Sin embargo los resultados de este experimento no fueron interpretados hasta años más tarde, cuando Lavoisier propuso que el agua no era un elemento sino un compuesto formado por oxígeno y por hidrógeno, siendo su formula H2O.
El agua es una biomolécula inorgánica. Se trata de la biomolécula más abundante en los seres vivos. Formas de vidas acuáticas y terrestre presentan gran cantidad de agua en su composición por ejemplo en las medusas, puede alcanzar el 98% del volumen del animal y en la lechuga, el 97% del volumen de la planta.

Cerca del 72% de la masa libre de grasa del cuerpo humano está hecha de agua. Para su adecuado funcionamiento nuestro cuerpo requiere entre uno y tres litros de agua diarios para evitar la deshidratación, la cantidad precisa depende del nivel de actividad, temperatura, humedad y otros factores. El cuerpo pierde agua por medio de la orina y las heces, la transpiración y la exhalación del vapor de agua en nuestro aliento.

Todas las formas de vida conocidas dependen del agua. El agua es parte vital de muchos procesos metabólicos en el cuerpo. Cantidades significantes de agua son usadas durante la digestión de la comida. Sin embargo, algunas bacterias y semillas de plantas pueden entrar a un estado criptobiótico por un período de tiempo indefinido cuando se deshidratan, y vuelven a la vida cuando se devuelven a un ambiente húmedo.
La criptobiosis, es un estado que consiste en la suspensión de los procesos metabólicos, a la que algunos seres vivos entran cuando las condiciones medioambientales llegan a ser extremas. Un organismo en estado criptobiótico puede vivir indefinidamente hasta que las condiciones sean habitables de nuevo.
Estructura del agua:
El agua a temperatura ambiente se encuentra en estado líquido cuando lo normal, debido a su bajo peso molecular, sería que fuese un gas. La explicación está en que las moléculas de agua presentan carácter dipolar a pesar de tener una carga total neutra. Y esto es así debido a que el oxígeno, el elemento más electronegativo, consigue que los electrones del enlace estén más tiempo cerca de él que de los átomos de hidrógeno, creando una asimetría que da origen a dos zonas con cargas distintas. Este hecho permite la formación de puentes de hidrógeno.

Los puentes de hidrógeno forman una fuerte tensión en el agua, como podemos observar en este video:
En este video se quiere hacer referencia a la fuerte tensión del agua, producto de todos los puentes de hidrogeno que pueden formar en el agua.
Propiedades físico-químicas del agua
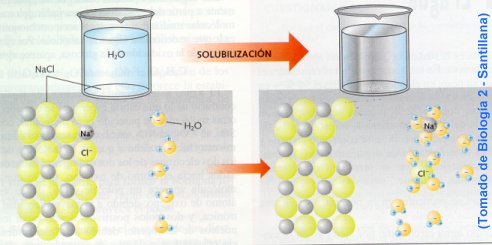
a)Acción disolvente.
El agua es el líquido que más sustancias disuelve (disolvente universal), esta propiedad se debe a su capacidad para formar puentes de hidrógeno con otras sustancias, ya que estas se disuelven cuando interaccionan con las moléculas polares del agua.
La capacidad disolvente es la responsable de dos funciones importantes para los seres vivos: es el medio en que transcurren las mayorías de las reacciones del metabolismo, y el aporte de nutrientes y la eliminación de desechos se realizan a través de sistemas de transporte acuosos.
b)Fuerza de cohesión entre sus moléculas.
Los puentes de hidrógeno mantienen a las moléculas fuertemente unidas, formando una estructura compacta que la convierte en un liquido casi incompresible.Por esta razón puede actuar como esqueleto hidrostático en algunos animales invertebrados (ej.: lombrices,equinodermos...), del mismo modo que permite la turgencia en las plantas.

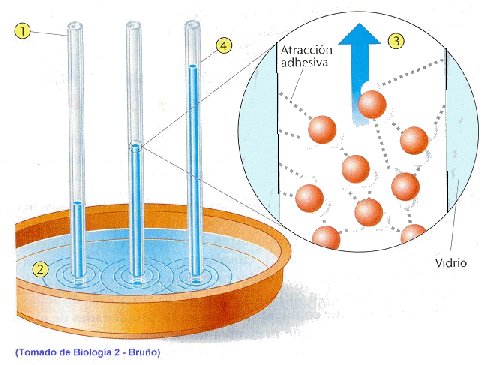
c) Elevada fuerza de adhesión. De nuevo los puentes de hidrógeno del agua son los responsables, al establecerse entre estos y otras moléculas polares, y es responsable, junto con la cohesión de la capilaridad, al cual se debe, en parte, la ascensión de la sabia bruta desde las raíces hasta las hojas.
d) Gran calor específico. El agua absorbe grandes cantidades de calor que utiliza en romper los puentes de hidrógeno. Su temperatura desciente más lentamente que la de otros líquidos a medida que va liberando energía al enfriarse. Esta propiedad permite al citoplasma acuoso servir de proteccción para las moléculas orgánicas en los cambios bruscos de temperatura.

e) Elevado calor de vaporización.
A 20ºC se precisan 540 calorías para evaporar un gramo de agua, lo que da idea de la energía necesaria para romper los puentes de hidrógeno establecidos entre las moléculas del agua líquida y, posteriormente, para dotar a estas moléculas de la energía cinética suficiente para abandonar la fase líquida y pasar al estado de vapor.
f) Elevada constante dieléctrica.
Por tener moléculas dipolares, el agua es un gran medio disolvente de compuestos iónicos, como las sales minerales, y de compuestos covalentes polares como los glúcidos.
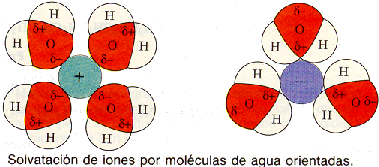 Las moléculas de agua, al ser polares, se disponen alrededor de los grupos polares del soluto, llegando a desdoblar los compuestos iónicos en aniones y cationes, que quedan así rodeados por moléculas de agua. Este fenómeno se llama solvatación iónica.
Las moléculas de agua, al ser polares, se disponen alrededor de los grupos polares del soluto, llegando a desdoblar los compuestos iónicos en aniones y cationes, que quedan así rodeados por moléculas de agua. Este fenómeno se llama solvatación iónica.
No hay comentarios:
Publicar un comentario